
Fibrosis Quística y cómo diagnosticarla
La fibrosis quística (FQ) es una enfermedad hereditaria en la que las personas afectadas producen mucosidades pegajosas; estas mucosidades son perjudiciales para el pulmón, causando infecciones respiratorias recurrentes, y bloquean la liberación de los enzimas pancreáticos, impidiendo la normal digestión de proteínas y grasas. La mayor parte de casos de FQ se diagnostica durante la primera infancia, siendo necesarios tratamientos diarios que ayuden a eliminar el exceso de mucosidades y a complementar las necesidades nutricionales mediante suplementos adecuados. Normalmente debe realizarse una monitorización rigurosa de las personas afectadas y se debe instaurar un tratamiento immediato de las infecciones, para así preservar la función pulmonar.
La fibrosis quística es una enfermedad relativamente frecuente causada por mutaciones en un gen localizado en el cromosoma 7. Este gen es el responsable de la producción normal de una proteína reguladora de la conductancia transmembrana de la fibrosis quística (CFTR, por sus siglas en inglés). Las mutaciones (alteraciones a nivel de ADN) de este gen conducen a la disminución, ausencia o a producción defectuosa de CFTR, provocando la FQ. Se han identificado más de 1500 mutaciones diferentes en este gen, aunque algunas son mucho más comunes que otras.
Como la FQ es una enfermedad autosómica recesiva, un individuo afectado de FQ debe tener una mutación en el gen CFTR en cada cromosoma 7, ha heredado una copia anormal de cada padre. Un individuo con un gen normal y otro mutado es un portador de FQ. Los portadores son individuos sanos que no tienen síntomas pero pueden pasar una copia del gen anormal a su descendencia. Por lo tanto, para tener un hijo con FQ, ambos padres biológicos deben tener como mínimo un gen anormal de la FQ. En otras palabras, ambos deben ser portadores o enfermos para poder transmitir la enfermedad a sus hijos. La población del norte de Europa son los grupos de población con mayor incidencia de FQ; cerca de 1 de cada 20-25 individuos son portadores de la FQ.
Las personas con FQ presentan una producción defectuosa o inexistente de proteína CFTR, que conlleva un intercambio anormal de agua y electrolitos en las células epiteliales. Esto, a su vez, provoca la aparición de mucosidades espesas y pegajosas en los pulmones y en el páncreas, que favorecen la aparición de infecciones respiratorias u obstrucción de los conductos pancreáticos y hepáticos, además de una maldigestión proteica. La mayoría de varones con FQ son infértiles debido a la ausencia o desarrollo anómalo del vaso deferente, el túbulo que transporta el esperma desde los testículos. La mayoría de personas con FQ desarrolla síntomas respiratorios y pancreáticos a edades tempranas, pero la severidad de los síntomas varía según los individuos, a pesar de que tengan exactamente la misma mutación.
Actualmente no existe ningún sistema de prevención o curación de la FQ y únicamente se pueden tratar los síntomas. En los últimos 10 años se han hecho grandes avances, que han permitido alargar la vida de estas personas y mejorar su calidad de vida.
Pruebas de Laboratorio relacionadas
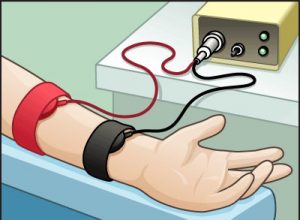
Prueba del sudor
El diagnóstico de FQ se realiza mediante la cuantificación del contenido de sal en el sudor.
La prueba de sudor es confiable y no dolorosa, y su análisis requiere profesionales entrenados y experimentados, que realicen un número elevado de pruebas al año con la técnica de Gibson y Cooke.
Generalmente se estimulan las glándulas sudoríparas de una zona del antebrazo con una sustancia (pilocarpina) y el paso de una corriente eléctrica débil (iontoforesis)
Se recoge el sudor y se determina el contenido de cloro y sodio. El procedimiento se completa en aproximadamente una hora
Debido a que la proteína CFTR está alterada o ausente y el transporte de cloruro se ve limitado, el sudor en una persona con FQ puede ser hasta cinco veces más salado que el de una persona sin la enfermedad.
Un resultado positivo de la prueba del sudor debe confirmarse y seguidamente se debe hacer un análisis de las mutaciones del gen de la FQ.
Mutación del gen de la fibrosis quística
El gen específico responsable de la FQ fue identificado en 1989 y hasta la fecha se han descubierto más de 1.000 mutaciones diferentes.
El descubrimiento del gen de la FQ ha posibilitado la identificación de individuos afectados y portadores, y ha contribuido a la comprensión de cómo y por qué se produce la enfermedad.
El American College of Medical Genetics (ACMG) y el American College of Obstetricians and Gynecologists (ACOG) recomiendan un panel que detecta 23 de las mutaciones más comunes del gen CFTR tanto en la población general como en poblaciones seleccionadas, para detectar así enfermos o portadores de la enfermedad.
La ACOG recomienda ofrecer el cribado de la FQ a todas las mujeres en edad fértil o embarazadas; en caso de que la madre sea portadora, debe realizarse el estudio en el padre biológico. La ACMG recomienda además realizar el análisis en otros familiares de riesgo. Si se identifican dos mutaciones causantes de FQ, una en cada uno de los progenitores, conviene que un consultor genético explique el riesgo relativo que la pareja tiene de concebir un hijo con FQ. Por otra parte, es muy importante recomendar también el consejo genético a todos los portadores y a personas con antecedentes familiares de FQ.
Pesquisa neonatal: Tripsina inmunoreactiva (IRT)
La FQ es una enfermedad de evolución progresiva y su pronóstico depende fundamentalmente de la oportunidad del diagnóstico. Existen evidencias claras que los niños diagnosticados mediante pesquisa neonatal (al nacer) y tratados adecuadamente, tienen mejor nutrición y función pulmonar que los diagnosticados por la presencia de síntomas.
La prueba de tripsina inmunorreactiva se basa en la observación que los recién nacidos afectados tienen concentraciones elevadas de esta enzima en sangre. La muestra debe obtenerse durante las primeras cuatro semanas de vida.
Se trata de un procedimiento de cribado para tripsinógeno en recién nacidos. El tripsinógeno se produce en el páncreas y se transporta al intestino donde se activa para formar la enzima tripsina. En la FQ, los tapones de moco espeso pueden obstruir los conductos pancreáticos e impedir el acceso del tripsinógeno al intestino. La concentración sanguínea de IRT puede estar elevada en recién nacidos con FQ, pero los resultados positivos deben confirmarse con otra prueba.
Tripsina y quimotripsina
Se trata de una prueba que se realiza en heces para detectar enzimas proteolíticas, que se producen de forma inactiva en el páncreas y se activan posteriormente en el intestino delgado para así digerir las proteínas de la dieta. Un resultado positivo indica normalidad. Es una prueba para el cribado de la suficiencia pancreática.
Detección de la Mutación DF508 para Fibrosis Quística
Suele haber importantes diferencias en el grado de afectación según las mutaciones que posee cada paciente.
La mutación más frecuente es la DF508; la frecuencia del resto es baja y muchas de ellas han sido halladas en grupos familiares únicos, por lo que es imposible el estudio de todas las mutaciones conocidas. Los pacientes portadores de DF508 presentan insuficiencia pancreática y altos niveles de cloruros en el sudor, y la mayoría tiene compromiso pulmonar que es variable en cuanto a severidad. En cambio, aquellos afectados con otras mutaciones pueden conservar cierta actividad del canal del cloro y las manifestaciones ser menos severas. No obstante, como ha sido mencionado, la evolución clínica es variable aún entre hermanos.
En nuestro país se observa que DF508 está presente en el 57% de los cromosomas Fq.
Fuente: Lab Tests Online
Realizar comentario
Noticias más leídas